COVID-19: Tratamento
- Publicado em COVID-19
Ilustração - Tratamento da COVID-191
Santos Morais Nicolau1, Paula Regina Oliveira2, Eduardo Ekundi Valentim3, André Pedro Neto4
1Faculdade de Medicina-Universidade Agostinho Neto
2Faculdade de Medicina-Universidade Katyavala Bwila
3Instituti Superior Politécnico-Malanje
4Faculdade de Medicina-Universidade Lueji A N’konde
- PREÂMBULO
Os fármacos são desenhados com três finalidades, a saber: diagnóstico, terapêutico e profilático. Os mesmos têm a sua origem na natureza: animal, vegetal ou mineral; podendo ser usados tal qual ou purificados, através dos avanços tecnológicos, sintéticos ou semi-sintéticos. É assim, temos hoje a diversidade de fármacos. No entanto, dado o facto dos fármacos não só causarem efeitos benéficos, mas também deletérios, e com base no que aconteceu em 1960 com a talidomida, hoje exigem-se estudos mais aprofundados para a validação da eficácia, segurança e bioequivalência dos medicamentos através do Ensaio Clínico (EC) (World Medical, 2013).
- ENSAIOS CLÍNICOS
O EC de fármacos é exigido com o objectivo de adquirirem-se informações sobre as propriedades farmacocinéticas e farmacodinâmicas de um potencial medicamento para humanos. Deve ser provada a eficácia e estabelecida uma margem de segurança adequada para o fármaco ser aprovado para comercialização. Actualmente no mundo existem apenas três agências que autorizam a realização de EC: a Food and Drugs Administration (FDA), a Agência Europeia de Medicamentos (EMA) e a Agência Australiana de Medicamentos (AAM). Devem ser apresentados os estudos de síntese, exames e triagem (pesquisa básica) e testes pré-clínicos “em animais” (fase inicial de desenvolvimento) antes de requerem-se os EC, o período de pesquisa básica e testes pré-clínicos pode durar entre seis a dez anos dependendo dos esforços e recursos dos interessados. De entre dez mil a vinte e cinco moléculas submetidas a EC, apenas uma chega a ser introduzida no mercado o que denota a rigorosidade do processo (Adams, 2011; Girard and Vohra, 2011; Mandal et al., 2011; Molewijk et al., 2011).
Superada a fase anterior (comprovada documentalmente) e a idoneidade dos requerentes, uma das Agência onde se submeteu a solicitação do EC autoriza que os EC tenham inicio. Este processo envolve quatro (4) fases e pode ultrapassar os dez anos, o que justifica o encarecimento dos medicamentos novos, pois a patente só é dada por vinte e cinco anos desde o momento de registo da molécula candidata na fase básica(Xie et al., 2007; Xie et al., 2009; Bayer et al., 2011; Chung and Kotsis, 2011; Mandal et al., 2011; Sanmukhani and Tripathi, 2011; Shafiq and Malhotra, 2011; Poirier and Mayer, 2013; World Medical, 2013; Schnipper et al., 2015).
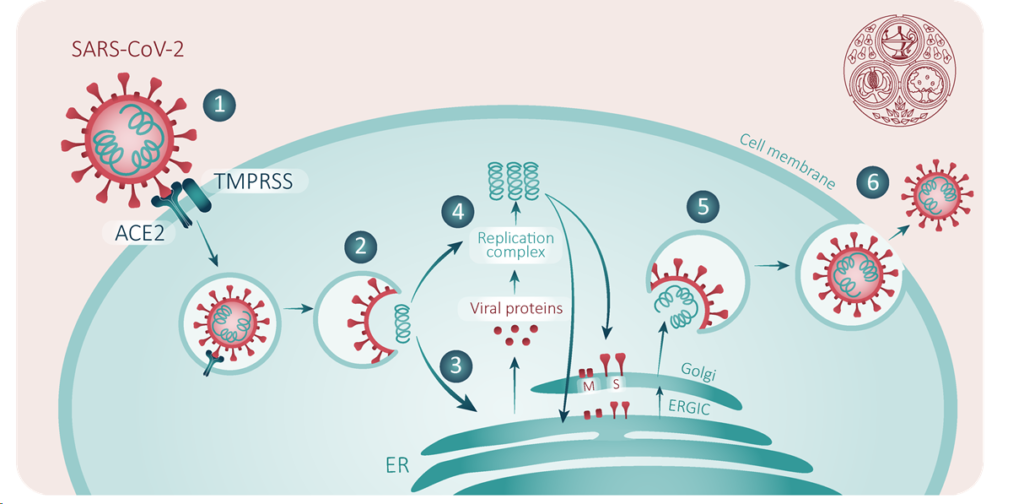
É assim que, os investigadores foram à quimioteca, buscar moléculas que haviam sido retiradas de comercialização e estão em curso os ensaios com cloroquina e hidroxicloroquina, remdesivir, lopinavir, ritonavir, cujos resultados ainda não são conclusivos (Gao et al., 2020; Guo et al., 2020).
- TERAPÊUTICA ANTI-COVID-19
Os aspectos discutidos acima levam a assegurar porquê é que leva-se tempo disponibilizar-se um novo medicamento. As equipas na diáspora que sempre trabalharam com vírus, na ausência de um protocolo definitivo para manuseamento de casos de COVID-19, têm tentado explorar muitos regimes terapêuticos, sendo que alguns destes mostram que foram testados de modo rápido e outros fazem erigir alguma esperança. Assim, existem esforços virados para: i) a terapia anti-viral, ii) o uso de anticorpo monocolonal, iii) a produção de vacinas (Caskey et al., 2015; Group et al., 2016; Gupta et al., 2016).
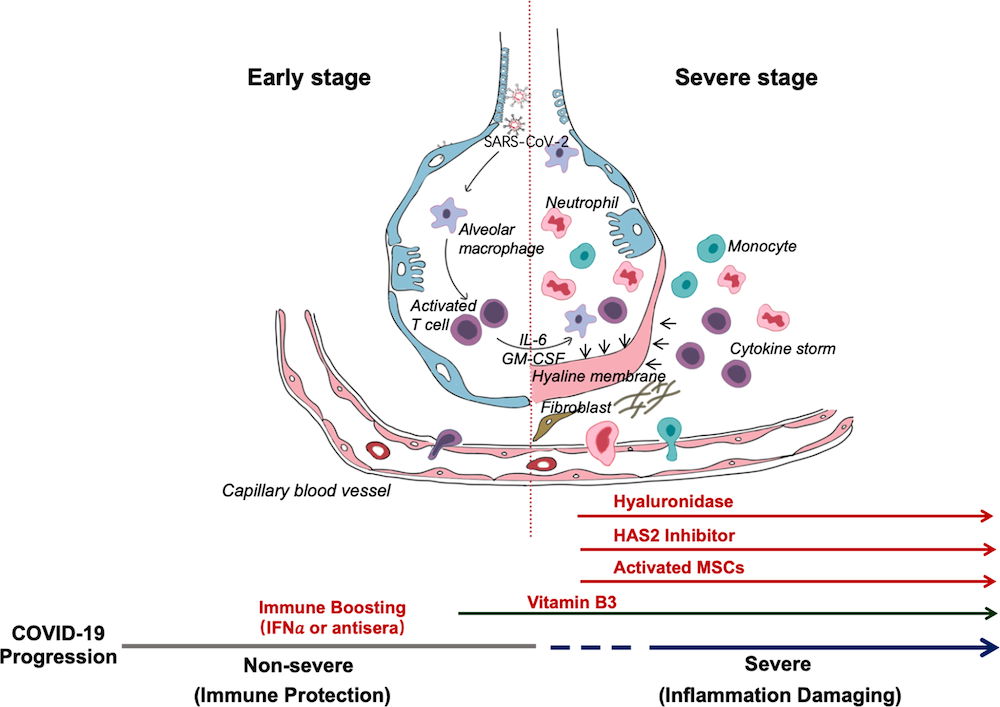
Por exemplo, a imunoglobulina humana (Jawhara, 2020), os interferons (Haiyan et al., 2020; Dong et al., 2020), a cloroquina e hidroxicloroquina (Dong et al., 2020; Gau et al., 2020; Gautret et al., 2020; Franke Xavier, 2020), o arbidol (Dong et al., 2020; Wang et al., 2020), o remdesivir, o favipiravir e o seltamivir (Lai et al., 2020; Wang et al., 2020; Zang et al., 2020) estão todos a ser testados e em diversas fases de estudo. Em anexo apresenta-se o quadro resumo de alguns estudos/ensaios feitos e/ou em curso para o tratamento da COVID-19. Além disso, está-se à procura de moléculas candidatas à vacinas, capazes de controlar a Covid-19. No entanto, até o presente momento não há nenhuma que neutralize o SARS-CoV-2. Segundo a OMS (WHO, 2020), até o mês de Fevereiro, havia um total de 21 de estas moléculas em fase pré-clinica e espera-se que na primavera a primeira candidata entre na Fase I (Fauci et al., 2020).
Mas enquanto se estudam essas possibilidades, os pacientes não podem esperar e devem ser atendidos, dada a evolução exponencial da doença comprometendo os órgãos vitais, de tal modo que uma conduta célere na atenção intensiva é recomendável com:
- oxigenoterapia
- analgésicos
- plasma dos pacientes recuperados+IgG (Guo et al., 2020)
- outros fármacos de cuidados intensivos.
Recomenda-se o uso do paracetamol, apesar de ter mais efeitos analgésicos do que antipiréticos, desaconselhando-se o ácido acetil-salicílico devido aos seus efeitos de desfosforilação da cadeia respiratória que podem agravar ainda mais a condição destes pacientes comprometidos nas suas vias respiratórias, além de seus efeitos serem irreversível ao nível do bloqueio da prostaglandina endoperóxido sintetase induzida e constituitiva a nível da Ser530 e Ser516 e seus efeitos deletérios a nível hematopoiético (Amann and Peskar, 2002; Bertolini et al., 2006; Ottani et al., 2006).
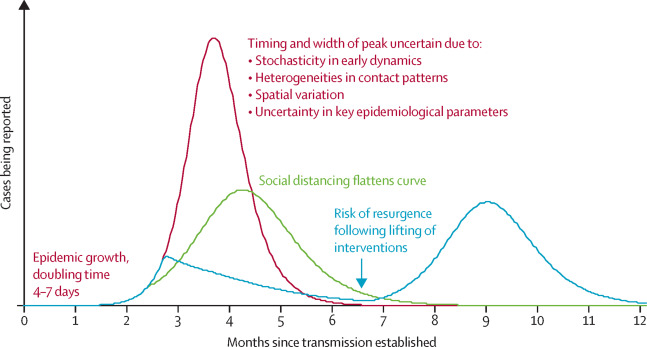
Em suma, as intervenções não farmacêuticas baseadas em distanciamento físico têm um forte potencial para reduzir a magnitude da epidemia da COVID-19 e levar a um número menor de casos. A redução e o achatamento do pico epidêmico é particularmente importante, pois isso reduz a pressão aguda nos serviços de saúde (Kiesha Prem et al., 2020).
- RECOMENDAÇÕES
- A melhor terapia para aqueles ainda não infectados, é a prevenção;
- Acatar a quarentena e a adesão as diversas medidas preventivas decretadas;
- Não usar outros anti-inflamatórios não esteróides (AINE), excepto o paracetamol;
- O uso de corticosteroides sistémicos não é recomendado.
- REFERÊNCIAS BIBLIOGRÁFICAS
Adams DM (2011) The role of the clinical ethics consultant in "unsettled" cases. J Clin Ethics 22:328-334; author reply 335-327.
Amann R and Peskar BA (2002) Anti-inflammatory effects of aspirin and sodium salicylate. Eur J Pharmacol 447:1-9.
Bayer R, Greco DB and Ramachandran R (2011) The ethics of clinical and epidemiological research. Int J Tuberc Lung Dis 15 Suppl 2:25-29.
Bertolini A, Ferrari A, Ottani A, Guerzoni S, Tacchi R and Leone S (2006) Paracetamol: new vistas of an old drug. CNS Drug Rev 12:250-275.
Caskey M, Klein F, Lorenzi JC, Seaman MS, West AP, Jr., Buckley N, Kremer G, Nogueira L, Braunschweig M, Scheid JF, Horwitz JA, Shimeliovich I, Ben-Avraham S, Witmer-Pack M, Platten M, Lehmann C, Burke LA, Hawthorne T, Gorelick RJ, Walker BD, Keler T, Gulick RM, Fatkenheuer G, Schlesinger SJ and Nussenzweig MC (2015) Viraemia suppressed in HIV-1-infected humans by broadly neutralizing antibody 3BNC117. Nature 522:487-491.
Chung KC and Kotsis SV (2011) The ethics of clinical research. J Hand Surg Am 36:308-315.
Gao J, Tian Z and Yang X (2020) Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. Biosci Trends 14:72-73.
Girard L and Vohra S (2011) Ethics of Using Herbal Medicine as Primary or Adjunct Treatment and Issues of Drug-Herb Interaction, in Herbal Medicine: Biomolecular and Clinical Aspects (nd, Benzie IFF and Wachtel-Galor S eds), Boca Raton (FL).
Group PIW, Multi-National PIIST, Davey RT, Jr., Dodd L, Proschan MA, Neaton J, Neuhaus Nordwall J, Koopmeiners JS, Beigel J, Tierney J, Lane HC, Fauci AS, Massaquoi MBF, Sahr F and Malvy D (2016) A Randomized, Controlled Trial of ZMapp for Ebola Virus Infection. N Engl J Med 375:1448-1456.
Guo YR, Cao QD, Hong ZS, Tan YY, Chen SD, Jin HJ, Tan KS, Wang DY and Yan Y (2020) The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak - an update on the status. Mil Med Res7:11.
Gupta P, Kamath AV, Park S, Chiu H, Lutman J, Maia M, Tan MW, Xu M, Swem L and Deng R (2016) Preclinical pharmacokinetics of MHAA4549A, a human monoclonal antibody to influenza A virus, and the prediction of its efficacious clinical dose for the treatment of patients hospitalized with influenza A. MAbs 8:991-997.
Jawhara S (2020) Could Intravenous Immunoglobulin Collected from Recovered Coronavirus Patients Protect against COVID-19 and Strengthen the Immune System of New Patients? Int J Mol Sci 21.
Mandal J, Halder A and Parija SC (2011) Ethics and clinical research. Trop Parasitol 1:54-56.
Molewijk B, Slowther A and Aulisio M (2011) The practical importance of theory in clinical ethics support services. Bioethics 25:ii-iii.
Ottani A, Leone S, Sandrini M, Ferrari A and Bertolini A (2006) The analgesic activity of paracetamol is prevented by the blockade of cannabinoid CB1 receptors. Eur J Pharmacol 531:280-281.
Poirier S and Mayer G (2013) The biology of PCSK9 from the endoplasmic reticulum to lysosomes: new and emerging therapeutics to control low-density lipoprotein cholesterol. Drug Des Devel Ther 7:1135-1148.
Sanmukhani J and Tripathi CB (2011) Ethics in clinical research: the Indian perspective. Indian J Pharm Sci 73:125-130.
Schnipper LE, Davidson NE, Wollins DS, Tyne C, Blayney DW, Blum D, Dicker AP, Ganz PA, Hoverman JR, Langdon R, Lyman GH, Meropol NJ, Mulvey T, Newcomer L, Peppercorn J, Polite B, Raghavan D, Rossi G, Saltz L, Schrag D, Smith TJ, Yu PP, Hudis CA, Schilsky RL and American Society of Clinical O (2015) American Society of Clinical Oncology Statement: A Conceptual Framework to Assess the Value of Cancer Treatment Options. J Clin Oncol 33:2563-2577.
Shafiq N and Malhotra S (2011) Ethics in clinical research: need for assessing comprehension of informed consent form? Contemp Clin Trials 32:169-172.
World Medical A (2013) World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA 310:2191-2194.
Xie L, Li J, Xie L and Bourne PE (2009) Drug discovery using chemical systems biology: identification of the protein-ligand binding network to explain the side effects of CETP inhibitors. PLoS Comput Biol 5:e1000387.
Xie L, Wang J and Bourne PE (2007) In silico elucidation of the molecular mechanism defining the adverse effect of selective estrogen receptor modulators. PLoS Comput Biol 3:e217.
ANEXOS
Resumo de alguns estudos feitos/em curso para o tratamento da COVID-19
|
Classes |
Opção Potencial de tratmento |
Referências |
|
Anti - viral |
Remdesivir, Ribavirin, Oseltamivir, ganciclovir, lopinavir/ritonavir, |
Lai CC, Shi TP, Ko WC, Tang HJ, Hsueh PR. Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) and coronavirus disease-2019 (COVID-19): The epidemic and the challenges. Int J Antimicrob Agents. 2020:105924. https://doi.org/10.1016/j.ijantimicag.2020.105924.
Library of Medicine (US). 2020 Mar 12 – Identifier NCT04303299, Various combination of Protease Inhibitors, Oseltamivir, Favipiravir, and Chloroquin for Treatment of COVID-19: A Randomized Control Trial (THDMS-COVID19)
|
|
Anti-maláricos |
Fosfato de Cloroquina: se mostrou efectiva contra a exacerbação da pneumonia devido as propriedades anti-virais e anti-inflamatórias
|
Gao J, Tian Z, Yang X. Breakthrough: chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. Biosci Trends. 2020; Available from: http://www.ncbi.nlm.nih.gov/pubmed/32074550. [cited 2020 Feb 22].
Gautret P, Lagier JC, Parola P, Hoang VT, Meddeb L, Mailhe, et al. Hydroxychloroquine and azithromycin as a treatment of COVID‐19: results of an open‐label non‐randomized clinical trial. Int J Antimicrob Agents – In Press 17 March 2020. https://doi.org/10.1016/j.ijantimicag.2020.105949
Bethesda (MD): National Library of Medicine (US). 2020 Mar 12 – Identifier NCT04303507, Chloroquine Prevention of Coronavirus Disease (COVID-19) in the Healthcare Setting (COPCOV). Available from: https://clinicaltrials.gov/ct2/show/NCT04303507?term=NCT04303507&draw=2&rank=1
ClinicalTrials.gov [Internet]. Bethesda (MD): National Library of Medicine (US). 2020 Mar 12 – Identifier NCT04261517. Efficacy and Safety of Hydroxychloroquine for Treatment of Pneumonia Caused by 2019-nCoV (HC-nCoV). Available from: https://clinicaltrials.gov/ct2/show/NCT04261517. |
|
Tratamento fitoterápicos |
Observou-se um amplo recurso à medicina tradicional chinesa durante o surto SARS-COV, e continua mem uso actualmente. As 5 plantas mais usadas sao:Radix (Huangqi), Glycyrrhizae Radix Et Rhizoma (Gancao), Saposhnikoviae Radix (Fangfeng), Atractylodis Macrocephalae Rhizoma (Baizhu), and Lonicerae Japonicae Flo. |
Luo H, Tang Q-L, Shang Y-X, Liang S-B, Yang M, Robinson N, et al. Can Chinese medicine be used for prevention of corona virus disease 2019 (COVID-19)? A review of historical classics, research evidence and current prevention programs. Chin J Integr Med. 2020; Available from: http://www.ncbi.nlm.nih.gov/pubmed/32065348. |
|
Anti - viral |
Darunavir + cobicistat: o primeiro é usado para o tratamento da infeção por VIH e o segundo para aumentar a sua biodisponibilidade via inibição da CYP3A. Serão testados em pacientes com pneumonia por COVID-19 (estudo clínico número NCT04252274)
|
ClinicalTrials.gov [Internet]. Bethesda (MD): National Library of Medicine (US). 2020 Mar 12 – Identifier NCT04252274. Efficacy and Safety of Darunavir and Cobicistat for Treatment of Pneumonia Caused by 2019-nCoV (DACO-nCoV). Available from: https://clinicaltrials.gov/ct2/show/NCT04252274 |
|
Interferons |
Recombinant human interferon é conhecido pelos seus efeitos inibitórios sobre o MERS-CoV e SARS-CoV, o propósito do estudo clínico é avaliação da eficácia deste interferm na nova infecção por coronavirus.
|
Haiyan Qiu; Junhua Wu; Liang Hong; Yunling Luo; Qifa Song; Dong Chen.Clinical and epidemiological features of 36 children with coronavirus disease 2019 (COVID-19) in Zhejiang, China: an observational cohort study. The Lancet Infectious Diseases, ISSN: 1473-3099, Vol: 0, Issue: 0, 2020; Available online 25 March 2020 https://doi.org/10.1016/S1473-3099(20)30198-5
ClinicalTrials.gov [Internet]. Bethesda (MD): National Library of Medicine (US). 2020 Mar 12 – Identifier NCT04293887, Efficacy and safety of IFN-a2b in the treatment of novel coronavirus patients. Available from: https://clinicaltrials.gov/ct2/show/NCT04293887?term=NCT04293887&draw=2&rank=1 |
|
Anti Oxidante não enzimático |
Vitamina C tem actividade anti oxidante pelo que pode reduzir o estresse oxidativo e inflamação, efeitos que melhoram a actividades das células imunológicas, função endovascular e proporciona modificações imuno epigenéticas. |
ClinicalTrials.gov [Internet]. Bethesda (MD): National Library of Medicine (US). 2020 Mar 12 – Identifier NCT04264533, Vitamina C infusion for the treatment of severe 2019-nCoV infected pneu- monia. Available from: https://clinicaltrials.gov/ct2/show/NCT04264533?term=NCT04264533&draw=2&rank=1
|
|
Imunoterápicos |
Bevacizumab é um anticorpo monoclonal humanizado que tem como alvo o factor vascular de crescimento endothelial (VEGF),pode reduzir os niveis de VEGF causados pela hipóxia, inflamação severa e hiper estimulação do epitélio do trato respiratório, podendo suprimeir o edema em pacientes com COVID-19
|
ClinicalTrials.gov [Internet]. Bethesda (MD): National Library of Medicine (US). 2020 Mar 12 – Identifier NCT04275414, Bevacizumab in severe or critical patients with Covid-19 pneumonia (BEST-CP). Available from: https://clinicaltrials.gov/ct2/show/NCT04275414?term=NCT04275414&draw=2&rank=1
|
|
Imunoterapia |
Administração de anticorpos IgG imunes coletados do plasma de pacientes recuperados contra o COVID-19. Estes aumentam a resposta imune em pacientes recém-infectados. |
Jawhara, S. Could Intravenous Immunoglobulin Collected from Recovered Coronavirus Patients Protect against COVID-19 and Strengthen the Immune System of New Patients? Int. J. Mol. Sci. 2020, 21, 2272. DOI:10.3390/ijms21072272
|