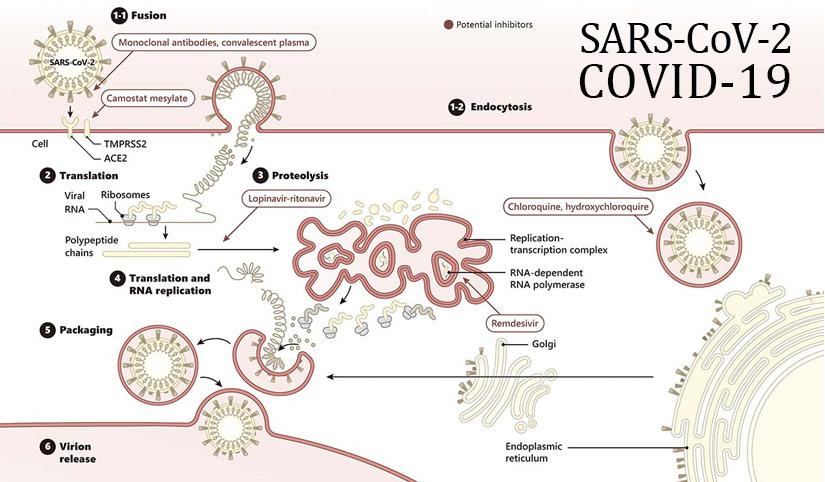
A COVID-19 NA GRAVIDEZ, PARTO, PUERPÉRIO E AMAMENTAÇÃO
- Publicado em COVID-19

Ilustração - Coronavírus na gravidez.1
Paulo Campos1, Pedro de Almeida2, Manuela Mendes3, Antónia Gustavo4, Lígia Alves5 e Julieta de Castro6
1MD, MSc. PhD Chefe de Departamento de Obst. e Gin. da Faculdade de Medicina da Universidade Agostinho Neto
2 MD, MSc, especialista em Gin/Obst. Chefe de Departamento de Investigação da Direcção Pedagógica e Científica da Maternidade Lucrécia Paím (MLP)
3 MD, MSc, especialista em Gin/Obst. Directora Geral da MLP
4 MD, MSc, especialista em Gin/Obst. Directora Pedagógica e Científica da MLP
5 MD, MSc, especialista em Gin/Obst. Directora Geral do Hospital Geral Especializado Augusto Ngangula
6 Especialista em Gin/Obst
Correspondência do Autor: Departamento de Ginecologia e Obstetrícia da Faculdade de Medicina da UAN Luanda Email Este endereço de email está protegido contra piratas. Necessita ativar o JavaScript para o visualizar.. Telemóvel (+244) 923.412.961
- INTRODUÇÃO
De acordo com Poon, et al. (2020) o coronavírus (CoV) é um vírus do ácido ribonucleico (RNA) de fita positiva da família dos 100 Coronaviridae e pertencentes à ordem Nidovirales, que geralmente causa problemas respiratórios e infecções gastrointestinais que podem variar de condições leves e autolimitadas a distúrbios mais graves, como pneumonia viral com comprometimento sistémico (Su et al., 2020). No final de 2019, uma nova mutação do CoV (rotulada como SARS-COV-2) foi identificada como a causa duma doença respiratória grave - chamada COVID-19 - que geralmente se apresenta com febre e tosse e as pessoas infectadas mostram achados radiológicos anormais, sugestivos de pneumonia (Huang et al., 2020). Depois que se passou a considerar como uma epidemia na China, a infecção por COVID-19 espalhou-se rapidamente para muitos outros países e o número de casos afectados continua a aumentar significativa e diariamente. A taxa geral de mortalidade varia de 3% a 4%, de acordo com o relatório da Organização Mundial da Saúde (Coronavirus disease 2019 (COVID-2019): situation report). No entanto, uma taxa mais alta de pacientes tem exigido admissão na unidade de cuidados intensivos (UCI) (Wang D, Hu B, Hu C et al. (2019). A COVID-19 foi declarada pela Organização Mundial de Saúde como pandemia internacional, no dia 11 de Março de 2020. Neste contexto, várias medidas têm sido adoptadas para conter a expansão da doença. É consenso em obstetícia que as adaptações fisiológicas maternas à gravidez predispõem as gestantes a um curso mais grave de pneumonia, com subsequente maior morbidade materna e fetal (Chen, Keller, Wang, Lin & Lin, 2012). A COVID-19 continua a ser um campo de pesquisa fértil em que ainda pouco se conhece, particularmente no que diz respeito aos seus efeitos sobre as mulheres grávidas e recém-nascidos. Isso limita o aconselhamento e conduta dessas pacientes (Poon et al., 2020). Não há ainda, praticamente, recomendações específicas para as mulheres grávidas, quanto à avaliação e conduta definitivas para a COVID- 19. O Colégio Americano de Obstetras e Ginecologistas (ACOG, 2020) recomenda que, sendo a pandemia da COVID-19 uma situação de rápida evolução, haja iniciativas locais e sistémicas, com a contribuição dos profissionais dos cuidados obstétricos de modo que se desenvolvam protocolos inovadores que possam ir de encontro às necessidades de saúde das pacientes. Nos Estados Unidos da América, deve-se ter em consideração as directrizes do Centro de Controle e Prevenção de Doenças (CDC), dos departamentos de saúde locais e estatais, a circulação comunitária, disponibilidade de pessoal da saúde, a geografia, acesso à rápida disponibilidade de recursos locais e a coordenação do Programa de Controlo do COVID-19.
Em Angola, é importante recolher informações actualizadas sobre como optimizar os cuidados obstétricos no contexto da COVID-19, uma vez que ainda são escassas as recomendações a este respeito no nosso meio. As presentes considerações deverão ser actualizadas cada vez que se disponha de mais informações sobre a infecção.
- EPIDEMIOLOGIA E A DESCRIÇÃO DA DOENÇA
De acordo com Di Mascio et al. (2020) e Huang et al. (2019) a COVID-19 é a última infecção por CoV identificada no final de 2019 em Wuhan, uma cidade na província de Hubei na China. Actualmente, a Europa tornou-se o epicentro da pandemia da COVID-19 (WHO COVID-2019: situation report), mas a infecção espalhou-se para mais de 150 países, levando os governos a adoptar medidas rigorosas de contenção para reduzir a disseminação viral bem como dos efeitos prejudiciais sobre os sistemas de saúde e sobre toda a economia dos países (Anderson, Heesterbeek, Klinkenberg, & Hollingsworth. 2020). É uma grave emergência de saúde pública e particularmente mortal em populações e comunidades vulneráveis nas quais os profissionais de saúde não estão suficientemente preparados para lidar com a infecção (Dashraath et al., 2019). Apesar da mortalidade relativamente baixa, uma das principais preocupações relacionadas à infecção pelo SARS-CoV-2 é o desenvolvimento duma síndrome do desconforto respiratório agudo, que é a ponta do iceberg clínico da pneumonia viral (Wang et al., 2019). A falta de conhecimento definitivo sobre a infecção pelo SARS-CoV-2 tem levantado questões pertinentes entre os médicos, relativamente ao tratamento clínico adequado e aos resultados esperados das pacientes afectadas, havendo actualmente necessidade premente de dados convincentes que orientem as decisões clínicas. A infecção pelo SARS-CoV-2 é actualmente uma emergência de saúde pública. Angola tem tido casos da doença considerados importados, estando em curso a planificação para o rastreio do vírus na comunidade, nomeadamente em pessoas suspeitas e/ou seus contactos para melhor controlo da doença.
- CARACTERÍSTICAS E TRANSMISSÃO DO COVID-19
A transmissão do SARS-CoV-2 entre seres humanos foi confirmada pela primeira vez durante a pandemia de coronavírus de 2019-20 (Chan et al., 2020). A principal forma de transmissão são gotículas produzidas no sistema respiratório e expulsas ao tossir ou espirrar até um raio de 1,8 m (Edwards 2020). Outra possível causa de infecção é o contacto indirecto através de superfícies contaminadas (WHO, 2020). A investigação preliminar sugere que o vírus possa permanecer activo em plástico e aço até três dias, embora não consiga sobreviver em cartão mais do que um dia ou em cobre mais do que quatro horas (Van Doremalen, 2020). Foi também observado ARN viral em fezes de pacientes infectados (Holshue et al., 2020).
O SARS-CoV-2 é o sétimo coronavírus conhecido capaz de infetar seres humanos, sendo os restantes o 229E, NL63, OC43, HKU1, MERS-CoV e o SARS-CoV original (Zhu et al., 2020). Foram identificados até agora sete vírus corona que poderiam infectar seres humanos. O SARS-CoV-1 e o coronavírus da síndrome respiratória do Oriente Médio (MERS-CoV) são ambos agentes patogénicos mortais. Como o vírus pode sobreviver em superfícies não-vivas, é essencial limpar frequentemente as superfícies tocada (Centers for Disease Control and Prevention, 2020).
As mulheres grávidas são particularmente susceptíveis a agentes patogénicos respiratórios e pneumonia grave, porque estão em estado imunossupressão e de alterações fisiológicas adaptativas durante a gravidez (por exemplo, elevação do diafragma, aumento do consumo de oxigénio e edema da mucosa do trato respiratório) que as tornam intolerantes àhipoxia (Chen et al., 2020).
Os dados actuais sobre a COVID-19 não indicam que as mulheres grávidas tenham um risco aumentado. Contudo as mulheres grávidas têm um risco maior de mortalidade e morbidade severas para outras infecções respiratórias tais como a gripe e a SARS. Assim, as gestantes devem ser consideradas uma população de risco para a COVID-19. Numa revisão sistemática, Di Mascio et al. (2020) relataram que os resultados mostraram que mais de 90% das mulheres grávidas hospitalizadas, afectadas por infecções por CoV apresentaram sinais radiológicos sugestivos de pneumonia, detectados em radiografia do tórax ou tomografia computadorizada e os sintomas mais comuns foram febre, tosse e linfopenia. As gestações afectadas por infecções por CoV apresentam altas taxas de parto pré-termo antes das 37 e 34 semanas e aborto quando a infecção é adquirida no início da gravidez. A pré-eclâmpsia e o parto por cesariana também foram mais comuns do que na população em geral. A taxa de mortalidade perinatal foi cerca de 10%, ao passo que o resultado perinatal adverso mais comum foi o sofrimento fetal, com mais da metade dos recém-nascidos internados na UCI. Os autores ainda ressaltam que as evidências clínicas da transmissão vertical não foram encontradas em nenhum dos recém-nascidos incluídos.
Nesta revisão sistemática, as mulheres afectadas pela COVID-19 apresentaram taxas mais altas de aborto, parto prematuro, pré-eclâmpsia, enquanto os bebés apresentaram maiores taxas de mortalidade perinatal (7-11%) e de admissão na UCI. Os casos são escassos e não está ainda suficientemente esclarecido se o SARS-CoV-2 atravessa a barreira placentária para o feto. A literatura recente conclui, em relação aos casos estudados, que nenhum dos recém-nascidos teve teste positivo para o SARS-CoV-2 (Di Mascio et al., 2020).
A possibilidade de transmissão vertical é altamente improvável e ainda não foi possível demonstrar nenhum caso, durante o actual surto de COVID-19 na China, nem em epidemias anteriores por outros coronavírus semelhantes (SARS-CoV e MERS-CoV). Os estudos existentes não evidenciaram a presença do vírus em fluidos genitais, líquido amniótico ou no leite materno. Os casos relatados de infecção em recém-nascidos provavelmente vêm de transmissão horizontal. O período de incubação usual é de 4 a 6 dias, mas pode variar entre 2 e 14 dias, existindo no entanto relatos de casos com mais de 21 dias após a infecção (Rasmussen, Smulian, Lednicky, Wen, & Jamieson, 2020).
NOTA IMPORTANTE: Devido à alta contagiosidade do SARS-CoV-2, recomenda-se que o pessoal de saúde que cuida de mulheres grávidas, siga rigorosamente as medidas de prevenção e protecção individual recomendadas pelo Ministério da Saúde e pela OMS, específicos do meio hospitalar (bata, luvas, chapéu, óculos, máscara, uniformes, etc.), dependendo do tipo de exposição, e que o material usado seja permanentemente limpo (cardiotocógrafos, aparelhos de ecografia e outros materiais), seguindo os regulamentos estabelecidos.
- DESCRIÇÃO DA DOENÇA
A maioria das pacientes tem doença leve, mas aproximadamente 20% evoluem para formas sérias. Os sintomas mais frequentes incluem febre (90%), tosse (76%), e dor muscular (44%). Os sintomas menos frequentes são: expectoração (28%), cefaleias (8%) e diarreia (3%). A presença de pneumonia com infiltrados bilaterais ou a presença da condensação radiológica é muito comum em pacientes sintomáticos. As alterações dos testes iniciais incluem linfopenia e leucopenia, aumento de LDH e PCR. As complicações incluem pneumonia grave, síndrome de desconforto respiratório agudo, distúrbios cardíacos e superinfecção respiratória. As mulheres grávidas não parecem ser mais susceptíveis à infecção, ou apresentar complicações sérias, mas os dados existentes são limitados. Em todo o caso, as complicações numa mulher grávida devem ser identificadas e tratadas precocemente (Di Mascio et al., 2020).
- COMPLICAÇÕES FETAIS
Os dados actuais não sugerem um risco aumentado de aborto ou perda precoce da gravidez em gestante infectada por SARS-CoV-2. Os resultados disponíveis em gestantes infectadas com SARS-CoV e MERS-CoV não demonstraram uma relação causal clara com essas complicações. Na ausência de evidências de transmissão intra-uterina, é altamente improvável que a infecção por COVID-19 possa causar defeitos ao feto. Foram descritos casos de parto prematuro em mulheres com infecção por SARS-CoV-2 e também foi observado nas infecções maternas por SARS-CoV e MERS-CoV. Embora em muitos casos a prematuridade possa ser induzida para preservar a saúde materna, muitos estudos, em mulheres grávidas com outros tipos de pneumonia viral, mostraram que existe um risco aumentado de trabalho de parto pré-termo, restrição de crescimento intrauterino (CIUR) e perda do bem-estar fetal intraparto (Liu et al., 2020).
- CONDUTAS PERANTE GRÁVIDAS COM INFECÇÃO
6.1. As pacientes deverão ser levadas com uma máscara cirúrgica, sem acompanhantes, para a área de isolamento estabelecido e os profissionais devem atendê-las, seguindo o protocolo de protecção estabelecido pelo programa do controlo da infecção do Ministério da Saúde (MINSA), que compreende o seguinte:
- avaliação clínica conjunta do especialista em ginecologia e obstetrícia e do anestesiologista, (minimizando as entradas na SALA).
- história clínica e exame físico: incluindo constantes (gasometria, saturação de O2) e auscultação respiratória, realizada com a paciente de costas para o profissional para minimizar o risco de contágio.
- radiografia do tórax: se houver indicação clínica, ela actuará como noutros adultos, não descurando as medidas usuais de protecção fetal (uso de avental abdominal).
- monitoramento fetal: ecografia para confirmar a viabilidade/bem-estar fetal.
6.2 Critérios de internamento:
Os critérios de gravidade e, portanto, de admissão são considerados pelas entidades que controlam a infecção, mas convém mencionar os seguintes dados relevantes:
- radiografia de tórax com infiltrado pulmonar ou outras imagens sugestivas de pneumonia.
- dificuldade respiratória grave: taquipnéia ou aumento da frequência respiratória com incapacidade de completar frases relativamente curtas (falta de ar); uso da musculatura acessória (circulação intercostal, sub ou supraclavicular) e sensação de asfixia.
- saturação de oxigénio por oximetria de pulso < 95%, respirando o ar ambiente.
- esgotamento respiratório caracterizado por padrão respiratório anormal, como por exemplo, alternar respirações rápidas e lentas ou longas pausas entre as respirações.
- evidência de desidratação clínica grave ou choque.
- alteração do nível de consciência: confusão, agitação ou convulsões.
- qualquer paciente gravemente imunocomprometida (transplante, infecção pelo vírus da imuno deficiência humana, VIH, tratamento prolongado com corticosteroides, neutropenia, linfopenia) e
- outros factores considerados pelo profissional de saúde responsável, nomeadamente os casos de alguma doença rapidamente progressiva ou invulgarmente longa.
6.2.1 Casos com critérios de admissão e investigação para a COVID-19 e gravidez
Os critérios para considerar um caso sob investigação estão continuamente dependentes da evolução da epidemia. Contudo, devem ser considerados:
- Casos sob investigação que atendem aos seguintes critérios:
- gestante hospitalizada por causa obstétrica (parto, ameaça de parto pré-termo ou outra) com febre e/ou sinais ou sintomas de infecção respiratória (tosse, falta de ar, dor de cabeça, rinorreia, garganta inflamada, mialgia, mal-estar; pode ser acompanhada por diarreia).
- se a paciente tiver febre isolada, antes de se considerar um caso sob investigação, excluindo outras causas (por exemplo, corioamnionite, pielonefrite).
- gestante com febre ≥ 38 ° C e/ou sinais ou sintomas de infecção respiratória que atender aos critérios de admissão hospitalar.
6.3 Procedimentos de diagnóstico nos casos que atendem aos critérios de pesquisa
Os procedimentos devem ser realizados por consenso com o especialista em Anestesiologia, Medicina Interna com vertente para Doenças Tropicais/Infecciosas e seguindo o protocolo de protecção e notificações estabelecido e específico do hospital para os casos sob investigação (Sahu, Mishra, & Lal, 2020), como os que se seguem:
- obtenção de amostras respiratórias: realiza-se com esfregaço do trato respiratório superior(nasofaríngea) e do trato respiratório inferior, selectivamente, nos casos em que determinar o médico especialista. Outra amostra nasofaríngea será obtida, seguindo o mesmo procedimento para descartar gripe e outras síndromes respiratórias virais (Breslin et al., 2020).
- radiografia de tórax: que se efectua se não tiver sido realizada anteriormente e em caso de indicação. O diagnóstico também se pode realizar por uma Tomografia Computadorizada (TC) do tórax. Para ambos exames deverão ser aplicadas as medidas usuais de protecção fetal com uso de avental abdominal (Kalafat et al., 2020).
- amostra de sangue para hematologia e bioquímica de acordo com protocolo específico pode ser colhida.
- MANUSEIO CLÍNICO DA GESTANTE
- CASO CONFIRMADO DA COVID-19 COM CRITÉRIOS DE ADMISSÃO
O manuseio clínico nesta situação deve ser valorizado conjuntamente por uma equipa multidisciplinar, incluindo especialistas em medicina materno-fetal (gineco-obstetra, pediatra, neonatologista, anestesiologista e infeciologista) para uma melhor decisão (González Romero, Ocampo Pérez, González Bautista, & Santana, 2020).
- GESTANTE ESTÁVEL CLÍNICAMENTE SEM CRITÉRIOS DE ADMISSÃO: SEGUIMIENTO AMBULATORIO
Depois da exclusão dos critérios de gravidade, a paciente poderá ter alta com recomendações e medidas de isolamento domiciliar, que compreendem os seguintes pontos:
- repouso domiciliar e controlo da temperatura.
- antipiréticos (Paracetamol 500 mg/8h).
- hidratação adequada (bebendo líquidos regularmente)
- isolamento domiciliar, com medidas de higiene das mãos e afastamento dos demais familiares.
- dar indicações claras sobre os motivos que levam a voltar à consulta de urgência (ex: aparecimento de dificuldade respiratória e/ou febre alta resistente a antipiréticos).
- as visitas rotineiras da gravidez, análises e ecografias deverão ser adiadas até ao fim do período de isolamento (González Romero, Ocampo Pérez, González Bautista, & Santana, 2020).
- PACIENTES COM INDICAÇÃO DE ADMISSÃO POR CAUSA OBSTÉTRICA:
Em uma paciente que recorra a consulta por motivo obstétrico com sintomas definidores de caso (febre, tosse, etc.) deverá proceder-se a medidas de isolamento e procedimentos diagnósticos para a COVID-19 específicos, de acordo com as directrizes sobre “Caso com critério de investigação”.
O pessoal de assistência materno-fetal não deverá actuar até que a paciente esteja convenientemente isolada e os profissionais dos cuidados de saúde protegidos de modo adequado. Na avaliação obstétrica de urgência deve proceder-se à recolha de material biológico para obtenção de amostras respiratórias, cumprindo o protocolo de diagnóstico para a COVID-19 (Boelig et al., 2020).
A paciente deverá permanecer em regime de isolamento de contacto até que se possa descartar o caso, de preferência numa sala com pressão negativa ou, na ausência deste tipo de sala, deve ser proporcionado à paciente um local adequado à sua condição. Em caso de confirmação do diagnóstico, manter-se-á o regime de isolamento até à negativação do teste de diagnóstico (PCR respiratório) sempre que haja critérios de internamento por motivos obstétricos. Deverá ser realizada uma avaliação do estado materno que inclua o controlo da temperatura, frequência respiratória e saturação de oxigénio e as decisões do manuseamento da infecção serão tomadas por consenso com o concurso do especialista em infecciologia de isolamento (González Romero, Ocampo Pérez, González Bautista, & Santana, 2020).
Os procedimentos terapêuticos obstétricos (Ameaça de Parto Pré-termo, Pré-eclampsia, e outros) serão os habituais, mas de forma muito racionalizada tanto para o controlo materno, como fetal, tendo em conta que a atenção médica e de enfermagem seja realizada de modo racional, apenas com o pessoal indispensável (Liang & Acharya, 2020).
Não está previsto o acompanhamento de modo regular por familiares, que provavelmente possam estar em regime de quarentena ou isolamento domiciliar. No entanto, poder-se-á considerar este acompanhamento no puerpério para tomar conta do recém-nascido e, neste caso, dever-se-á instruir o familiar no uso de medidas de protecção adequadas para si e o concepto (Ferrazzi et al., 2020).
A evidência actual sugere que, no contexto de uma infecção pelo SARS-CoV-2, a administração de corticoides para a maturação pulmonar fetal não produz efeitos prejudiciais maternos (ACOG 2020). De qualquer maneira, quando for indicada a sua administração, especialmente em doentes com complicações, a decisão deverá ser tomada em consenso com o especialista em infecciologia e neonatologia (Chen et al., 2020).
Terminação da gravidez: numa gestante com infecção pela COVID-19 ou suspeita e clinicamente estável, não há indicação de acelerar o parto ou realizar cesariana. De preferência deve-se realizar o parto quando a paciente tiver amostras negativas para a infecção (Ferrazzi et al., 2020).
- ATENÇÃO AO PARTO
Nas gestantes com a COVID-19 sem critérios de gravidade com início espontâneo de trabalho de parto ou com indicação de terminar a gravidez por causas obstétricas (Ruptura Prematura de Membranas, Gravidez Prolongada, Profilaxia para o Sofrimento Fetal, ou outras) a via de parto dependerá das condições obstétricas e do estado fetal.
Todo trabalho de parto realizar-se-á numa única sala, de preferência com pressão negativa ou, na falta disso, num bloco operatório, designado pelo protocolo vigente. A paciente deverá utilizar a máscara cirúrgica durante todo o processo e em qualquer dos dois cenários deverá minimizar-se ao máximo o pessoal implicado (Chen et al., 2020).
Para minimizar os riscos da transmissão materno-fetal, aconselha-se a pinçar o cordão umbilical de modo precoce e evitar o contacto pele com pele. Geralmente não se deve retirar o sangue do cordão para qualquer procedimento, como a doação, por exemplo.
- Conduta no parto vaginal: considerações pertinentes
A monitorização contínua com cardiotacografia (CTG) é importante, tendo em conta o possível risco aumentado de perda do bem-estar fetal, segundo os dados publicados pela experiência da República Popular da China.
É mandatório o controlo da temperatura, frequência respiratória e saturação do oxigénio de hora a hora.
A analgesia/anestesia loco-regional não está contra-indicada em gestantes com suspeita ou com infecção confirmada pelo SARS-CoV-2. De preferência, dever-se-ia administrar de forma precoce para minimizar o risco de uma anestesia geral em caso de necessidade de cesariana (ACOG, 2020).
Alguns autores como Xiong et al., (2020) consideram que se deve abreviar o período expulsivo com vácuo ou fórceps se houver critérios obstétricos.
- Indicações de cesariana
As indicações de cesariana devem ser as obstétricas habituais: indicação materna, sempre que a situação clínica piore de forma significativa durante o parto. Sharma et al., (2020) enfatizaram a realização de cesariana se as condições cervicais forem desfavoráveis.
- ATENÇÃO À GESTANTE COM INFECÇÃO GRAVE OU EVOLUÇÃO DESFAVORÁVEL
Em caso de evolução desfavorável materna da COVID-19, durante a gestação, parto e puerpério, a paciente deverá ser transferida, sob consenso da equipa multidisciplinar, para o local adequado e melhor equipado de acordo com as directrizes do MINSA. A decisão deverá ser tomada em função da gravidade materna, dos riscos e da idade gestacional, mas a prioridade principal será o bem-estar materno e fetal.
Actualmente não existe um tratamento específico para a COVID-19, mas no caso de cuidados para as situações complicadas, estão a ser implementados tratamentos com inibidores da protéase (Lopinavir/ritonavir), associados com o anti-palúdico (Hidroxicloroquina). Nos casos mais graves está a ser utilizado o Interferon ß. Estes tratamentos não estão contraindicados durante a gravidez (Da Silveira Cespedes & Souza, 2020).
- MANUSEIO PÓS-PARTO
A evidência actual indica que o risco de transmissão vertical intraparto, ou através do aleitamento materno é muito pouco provável e os casos de infecção neonatal descritos provêm de transmissão respiratória (transmissão horizontal). Apesar disso, a todos os recém-nascidos de mães com infecção confirmada, devem ser retiradas amostras biológicas para o diagnóstico. Para evitar o contacto horizontal, é necessário o isolamento de contactos e das secreções (gotículas do recém-nascido). No entanto, a criança poderá ser levada ao quarto de sua mãe, tendo esta uma máscara, ficando separada do filho, a uma distância de pelo menos 2 metros ou ficando separados por um biombo. Uma vez descartada a infecção do recém-nascido, se o estado de saúde o permitir e de modo consensual com a própria mãe, poder-se-á dar alta hospitalar sob responsabilidade de um familiar que não seja considerado como contacto com eventual exposição (Mimouni et al., 2020).
- Aleitamento materno
Seguindo as recomendações da maioria das sociedades científicas nacionais e internacionais (CDC, ACOG, OMS e MINSA), se o estado materno e neonatal o permitir, recomenda-se que se promova a lactação materna, mesmo durante o período de risco infeccioso com medidas estritas de isolamento (uso de máscaras cirúrgicas, lavagem correcta das mãos antes e depois das mamadas, limpeza da pele ao nível mamário e as superfícies que possam estar em contacto.
Uma alternativa sugerida por alguns especialistas seria a extracção do leite com uma bomba extractora de uso individual, com estritas medidas de higiene. O extractor deve limpar-se depois de cada extracção, com desinfectantes adequados. O leite materno seria administrado ao recém-nascido de preferência por um familiar não considerado contacto exposto ou por pessoal sanitário. No entanto, poder-se-á considerar que seja a própria mãe a fazê-lo, mas com estritas medidas de segurança com a utilização de máscara cirúrgica e correcta higiene das mãos (Karimi-Zarchi et al., 2020).
O grupo de peritos chineses recomenda a lactação artificial de recém-nascidos de mães infectadas, até que se exclua a possibilidade de transmissão vertical pela COVID-19. A produção de leite pode manter-se mediante a extracção, para evitar que haja congestão mamária e possibilitar que se possa mais tarde iniciar o aleitamento a peito, caso se exclua a infecção. Esse leite extraído deve ser inutilizado.
A decisão final sobre o tipo de aleitamento deverá ser do consenso entre a paciente e o neonatologista com base nos conhecimentos científicos de cada momento e o estado de saúde da mãe e do respectivo recém-nascido.
No caso de uma puérpera com infecção pela COVID-19, o aleitamento estabelecido não implica a interrupção da lactação, desde que sejam tomadas as medidas preventivas de transmissão respiratória (Ferrazzi et al., 2020).
- Transmissibilidade
A transmissibilidade se dá principalmente por gotículas devido ao contacto interpessoal íntimo (inferior a 2 m por tempo prolongado) ou a vómito. Estudos nos EUA com 445 lactantes infectadas permitiram estimar a taxa de contágio social em 0,45%. A transmissão oral-fecal é possível (devido à presença da enzima conversora da angiotensina 2, ECA2, no trato gastrointestinal e presença de RT-PCR positivo em amostras de fezes). Contudo, existem hipóteses abertas nesse sentido e estão em curso pesquisas para a sua documentação. Há relato de possível transmissão vertical intra-útero no terceiro trimestre, com neonato assintomático, mas apresentando elevação de citocinas e IgM positivo (Da Silveira Cespedes & Souza, 2020).
- FLUXOGRAMA RECOMENDADO PARA AS GESTANTES
A avaliação ambulatória e o manuseio de mulheres grávidas com suspeita ou confirmação de infecção pelo SARS-Cov-2 é preocupação dos obstetras e ginecologistas, porque ao contrário da gripe e de outras doenças respiratórias, tendo em conta o número limitado de casos confirmados de COVID-19, as mulheres grávidas não parecem estar em maior risco de doença grave. No entanto, dada a falta de dados e experiência com outros coronavírus, como o SARS-CoV e o MERS-CoV, é necessária diligência na avaliação e tratamento de mulheres grávidas.
A ACOG 2020 em parceria com a Society for Maternal-Fetal Medicine apresentam um Fluxograma, que foi desenvolvido para ajudar os profissionais a avaliar e tratar prontamente as pessoas grávidas com exposição conhecida e/ou com sintomas sugestivos e consistentes da COVID-19 bem como para os casos de pessoas sob investigação.
No entanto, a ACOG adverte que a COVID-19 é uma situação em rápida evolução e a orientação que apresenta pode se tornar desactualizada à medida que surjam novas informações disponíveis sobre a doença em mulheres grávidas. O quadro a seguir ilustra o fluxograma traduzido e adaptado para a língua portuguesa.
Conflito de Interesses: Os autores declaram que não há qualquer conflito de interesses e, sendo todos da mesma especialidade, contribuíram igualmente para a elaboração do texto.
1- https://www.baptistjax.com/juice/Stories/pregnancy-childbirth/covid-19-and-pregnancy

- RERERÊNCIAS BIBLIOGRÁFICAS
ACOG. (2020, Abril 10). COVID-19 FAQs for Obstetrician-Gynecologists, Gynecology. Acesso em 17 de Abril de 2020, disponível em ACOG: https://www.acog.org/clinical-information/physician-faqs/covid19-faqs-for-ob-gyns-gynecology
Anderson RM, Heesterbeek H, Klinkenberg D, Hollingsworth TD. (2020). How will country-based mitigation measures influence the course of the COVID-19 epidemic? Publicado online. 2020; S0140-6736(20)30567-5. https://doi.org/10.1016/S0140- 6736(20)30567-5
Boelig, R. C., Manuck, T., Oliver, E. A., Di Mascio, D., Saccone, G., Bellussi, F., & Berghella, V. (2020). Labor and delivery guidance for COVID-19. American Journal of Obstetrics & Gynecology MFM, 100110. https://doi.org/10.1016/j.ajogmf.2020.100110
Breslin, N., Baptiste, C., Gyamfi-Bannerman, C., Miller, R., Martinez, R., Bernstein, K., Ring, L., Landau, R., Purisch, S., Friedman, A. M., Fuchs, K., Sutton, D., Andrikopoulou, M., Rupley, D., Sheen, J.-J., Aubey, J., Zork, N., Moroz, L., Mourad, M., … Goffman, D. (2020). Coronavirus disease 2019 infection among asymptomatic and symptomatic pregnant women: Two weeks of confirmed presentations to an affiliated pair of New York City hospitals. American Journal of Obstetrics & Gynecology MFM, 100118. https://doi.org/10.1016/j.ajogmf.2020.100118
Centers for Disease Control and Prevention. (2020). Disinfecting your home if someone is sick. Acessado em 20 de Abril de 2020, disponível em CDC: https://www.cdc.gov/coronavirus/2019-ncov/prepare/disinfecting-your-home.html
Chen H, Guo J, Wang C, et al. (2020) Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. Lancet; 395:809–815
Chen YH, Keller J, Wang IT, Lin CC, Lin HC. (2012) Pneumonia and pregnancy outcomes: a nationwide population-based study. Am J Obstet Gynecol; 207:288.e1–288.e2887.
Chen, D., Yang, H., Cao, Y., Cheng, W., Duan, T., Fan, C., Fan, S., Feng, L., Gao, Y., He, F., He, J., Hu, Y., Jiang, Y., Li, Y., Li, J., Li, X., Li, X., Lin, K., Liu, C., … Guan, X. (2020). Expert consensus for managing pregnant women and neonates born to mothers with suspected or confirmed novel coronavirus ( COVID ‐19) infection. International Journal of Gynecology & Obstetrics, 149(2), 130–136. https://doi.org/10.1002/ijgo.13146
Da Silveira Cespedes, M., & Souza, J. C. (2020). SARS-CoV-2: Uma revisão para o clínico [Preprint]. https://doi.org/10.1590/SciELOPreprints.2
Dashraath P, Jing Lin Jeslyn W, Mei Xian Karen L, Li Min L, Sarah L, Biswas A, Arjandas Choolani M, Mattar C, Lin SL, Coronavirus Disease 2019 (COVID-19) Pandemic and Pregnancy, American Journal of Obstetrics and Gynecology (2020), doi: https://doi.org/10.1016/ j.ajog.2020.03.021
Di Mascio, D., Khalil, A., Saccone, G., Rizzo, G., Buca, D., Liberati, M., Vecchiet, J., Nappi, L., Scambia, G., Berghella, V., & D'Antonio, F. (2020). Outcome of Coronavirus spectrum infections (SARS, MERS, COVID-19) during pregnancy: a systematic review and meta-analysis. American journal of obstetrics & gynecology MFM, 100107. Advance online publication. https://doi.org/10.1016/j.ajogmf.2020.100107
Edwards, E., Miller, S. (2020, Janeiro 22). How does coronavírus spread? Acesso em 13 de Março de 2020, disponível em NBC News: https://www.nbcnews.com/health/health-news/what-new-coronavirus-n1119081
Ferrazzi, E. M., Frigerio, L., Cetin, I., Vergani, P., Spinillo, A., Prefumo, F., Pellegrini, E., & Gargantini, G. (2020). COVID-19 Obstetrics Task Force, Lombardy, Italy: executive management summary and short report of outcome. International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics, 10.1002/ijgo.13162. Advance online publication. https://doi.org/10.1002/ijgo.13162
González Romero, D., Ocampo Pérez, J., González Bautista, L., & Santana-Cabrera, L. (2020). Pronóstico perinatal y de la paciente embarazada con infección por COVID-19. Revista Clínica Española, S0014256520301120. https://doi.org/10.1016/j.rce.2020.04.006
Huang C, Wang Y, Li X et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. Lancet. 2020; 395:497–506.
Holshue ML, DeBolt C, Lindquist S, et al. (2020, Março). «First Case of 2019 Novel Coronavirus in the United States». The New England Journal of Medicine. 382 (10): 929–936. PMID 32004427. https://doi.org/10.1056/NEJMoa200119138
Kalafat, E., Yaprak, E., Cinar, G., Varli, B., Ozisik, S., Uzun, C., Azap, A., & Koc, A. (2020). Lung ultrasound and computed tomographic findings in pregnant woman with COVID‐19. Ultrasound in Obstetrics & Gynecology, uog.22034. https://doi.org/10.1002/uog.22034
Karimi-Zarchi, M., Neamatzadeh, H., Dastgheib, S. A., Abbasi, H., Mirjalili, S. R., Behforouz, A., Ferdosian, F., & Bahrami, R. (2020). Vertical Transmission of Coronavirus Disease 19 (COVID-19) from Infected Pregnant Mothers to Neonates: A Review. Fetal and Pediatric Pathology, 1–5. https://doi.org/10.1080/15513815.2020.1747120
Liang, H., & Acharya, G. (2020). Novel corona virus disease (COVID‐19) in pregnancy: What clinical recommendations to follow? Acta Obstetricia et Gynecologica Scandinavica, 99(4), 439–442. https://doi.org/10.1111/aogs.13836
Liu, D., Li, L., Wu, X., Zheng, D., Wang, J., Yang, L., & Zheng, C. (2020). Pregnancy and Perinatal Outcomes of Women With Coronavirus Disease (COVID-19) Pneumonia: A Preliminary Analysis. AJR. American journal of roentgenology, 1–6. Advance online publication. https://doi.org/10.2214/AJR.20.23072
Mimouni, F., Lakshminrusimha, S., Pearlman, S. A., Raju, T., Gallagher, P. G., & Mendlovic, J. (2020). Perinatal aspects on the covid-19 pandemic: a practical resource for perinatal-neonatal specialists. Journal of perinatology: official journal of the California Perinatal Association, 10.1038/s41372-020-0665-6. Advance online publication. https://doi.org/10.1038/s41372-020-0665
Poon, L. C., Yang, H., Kapur, A., Melamed, N., Dao, B., Divakar, H., David McIntyre, H., Kihara, A. B., Ayres-de-Campos, D., Ferrazzi, E. M., Carlo Di Renzo, G., & Hod, M. (2020). Global interim guidance on coronavirus disease 2019 (COVID-19) during pregnancy and puerperium from FIGO and allied partners: Information for healthcare professionals. International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics, 10.1002/ijgo.13156. Advance online publication. https://doi.org/10.1002/ijgo.13156
Rasmussen SA, Smulian JC, Lednicky JA, Wen TS, Jamieson DJ. Coronavirus Disease 2019 (COVID-19) and pregnancy: what obstetricians need to know [published online ahead of print, 2020 Feb 24]. Am J Obstet Gynecol. 2020;S0002-9378(20)30197-6. doi:10.1016/j.ajog.2020.02.017
Sahu, K. K., Mishra, A. K., & Lal, A. (2020). A twin challenge to handle: COVID-19 with pregnancy: LETTER TO THE EDITOR. Journal of Medical Virology. https://doi.org/10.1002/jmv.25784
Sharma, K. A., Kumari, R., Kachhawa, G., Chhabra, A., Agarwal, R., Sharma, A., Kumar, S., & Bhatla, N. (2020). Management of the first patient with confirmed COVID‐19 in pregnancy in India: From guidelines to frontlines. International Journal of Gynecology & Obstetrics, ijgo.13179. https://doi.org/10.1002/ijgo.13179
Su S, Wong G, Shi W et al. (2016) Epidemiology, Genetic Recombination, and Pathogenesis of Coronaviruses. Trends Microbiol. 24:490–502.
Van Doremalen N, Bushmaker T, Morris DH, et al. (2020, Março 17). «Correspondence: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1». The New England Journal of Medicine. PMID 32182409. doi:10.1056/NEJMc200497337
Wang D, Hu B, Hu C et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China JAMA. 2020; e201585.
WHO. (2020). Getting your workplace ready for COVID-19. Disponível em: https://www.who.int/docs/default-source/coronaviruse/getting-workplace-ready-for-covid-19.pdf.
Xiong, X., Wei, H., Zhang, Z., Chang, J., Ma, X., Gao, X., Chen, Q., & Pang, Q. (2020). Vaginal Delivery Report of a Healthy Neonate Born to a Convalescent Mother with COVID-19. Journal of medical virology, 10.1002/jmv.25857. Advance online publication. https://doi.org/10.1002/jmv.258
Zhu N, Zhang D, Wang W, et al. (2020, Fevereiro). «A Novel Coronavirus from Patients with Pneumonia in China, 2019». The New England Journal of Medicine. 382 (8): 727–733. PMID 31978945. https://doi.org/10.1056/NEJMoa200101745