Epidemiologia e Fisiopatologia
- Publicado em COVID-19
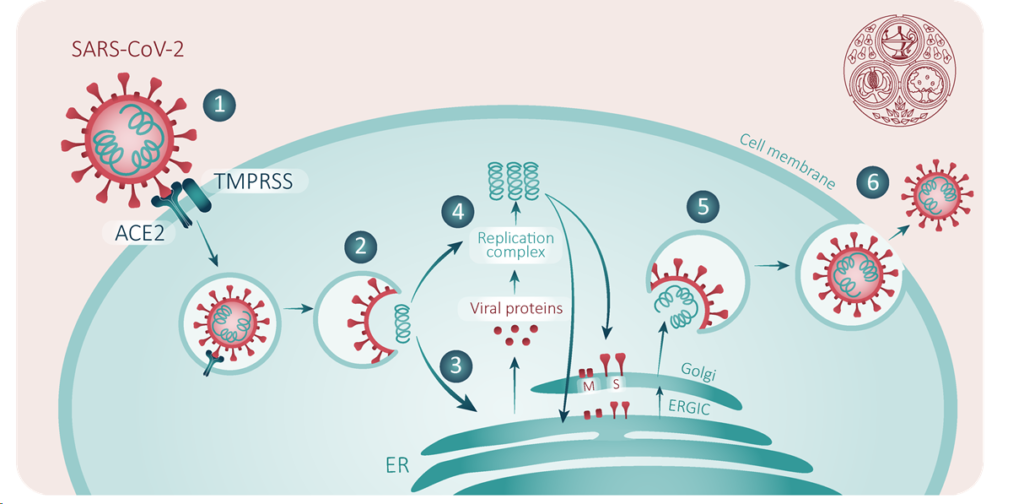
Ciclo de replicação do SARS-Cov-21
Pedro Magalhães1, Daniel Pires Capingana2, Ema Cândido Branco Fernandes3, José Belchior da Silva3 e Manuel João de Lemos3
1Departamento de Ciências Fisiológicas da Faculdade de Medicina da Universidade Agostinho Neto
2Instituto Superior de Ciências de Saúde da Universidade Cuito Cuanavale
3Departamento de Saúde Pública da Faculdade de Medicina da Universidade Agostinho Neto
Incidência e distribuição geográfica
A República da China informou a Organização Mundial da Saúde (OMS), a 31 de Dezembro de 2019, a existência de casos de pneumonia cuja etiologia era desconhecida. Estes casos foram identificados na cidade de Wuhan, província de Hubei. Até ao dia 03 de Janeiro de 2020 foram notificados 44 casos, mas somente a 07 de Janeiro foi identificado, na China, como agente etiológico um novo tipo de coronavírus que veio a receber a designação de SARS-CoV-2, com a posterior identificação da sua sequência genética alguns dias depois (WHO, 2020 b).
A Tailândia, o Japão e a República da Coreia foram os primeiros países a reportarem casos positivos importados da cidade de Wuhan. Dos 282 casos positivos reportados a 20 de Janeiro de 2020, 98,6% eram da China e, destes, 7,2% eram externos à província de Hubei (WHO, 2020b).
Cinco dias depois (25 de Janeiro), o total de casos novos no Mundo era de 1030, com o epicentro na China, com 1219 casos novos confirmados e 1965 casos suspeitos; mais nove países tinham casos positivos, todos importados da China. Os países afectados fora da Ásia eram a Austrália, os Estados Unidos da América e a França (WHO, 2020f).
A 11 de Março a OMS declara a doença provocada pelo SARS-CoV-2 (COVID-19) como pandemia, numa altura em que havia cerca de 118.000 casos em 114 países e 4.291 óbitos com milhares de pessoas lutando pela vida em hospitais (WHO, 2020g).
Embora os números mudem constantemente, de acordo com o relatório da OMS, no dia 18 de Abril, existiam no mundo 2.078.605 casos confirmados (77.846 novos casos) e 139.515 óbitos verificados no conjunto de 213 países e territórios, sendo que mais de metade dos casos foi reportada na região Europeia, seguindo-se a região das Américas, onde predominavam os Estados Unidos da América com 632.781 casos (WHO, 2020 h). Deste modo, estima-se um número de 288,1 casos por um milhão de habitantes no mundo. Até ao dia 18 de Abril, em Angola estavam registados 19 casos (correspondente a 0,61 casos por um milhão de habitantes), todos importados e localizados na província de Luanda. Registaram-se cinco altas, com melhoria, e dois óbitos. Os casos que evoluíram para óbito referem-se a pacientes que deram entrada com co-morbidades crónicas.
Transmissibilidade e medidas de mitigação
Os pacientes infectados pelo coronavírus (sintomáticos ou assintomáticos) são a principal fonte de infecção. A transmissão de pessoa a pessoa pode ocorrer de modo directo, através de gotículas respiratórias (tossir, espirrar e falar), que é muito frequente em ambiente familiar e hospitalar. A transmissão indirecta pode ocorrer por contacto das mãos com superfícies secas ou objectos contaminados, sendo os vírus introduzidos no organismo por auto-inoculação através das mucosas dos olhos, nariz ou boca. Contudo, também tem sido sugerida a possibilidade de transmissão fecal-oral (Jawetz Melnick, & Adelberg’s, 2016, p.4-5).
Para a COVID-19, a transmissão ocorre com uma rápida propagação, o que constitui um grande desafio para o seu controlo. Com base no padrão de propagação desta doença observado na população Chinesa, foram efectuados estudos para tentar demonstrar a transmissibilidade e prever a sua disseminação. Para tal, e usando um modelo matemático, estimou-se o índice de reprodução (R0), partindo de um caso índice que corresponde ao número médio de pessoas que um indivíduo infectado irá transmitir a doença. Nos casos em que o R0 é maior do que 1 significa que a doença irá manter a transmissibilidade. Para a COVID-19 a média do R0 é de 2,2 a 2,3 com um período de duplicação de casos de 6,4 dias, (Baker et al., 2020; Li et al., 2020), isso significa que existe a probabilidade de um indivíduo infectado transmitir a doença a 2,3 a 2,6 pessoas e com possível duplicação desse número num intervalo de 6,4 dias. Com esta constatação previu-se que a disseminação da doença seria muito rápida (R0 <1), sendo pertinente a adopção de medidas de mitigação (Prompetchara et al., 2020).
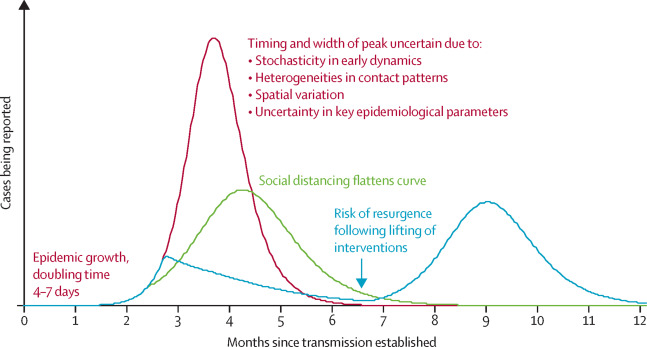
Simulações ilustrativas de um modelo de transmissão do COVID-192
Novas evidências sobre a transmissão da COVID-19 têm sido reportadas, referindo que a mesma pode ocorrer em indivíduos sintomáticos, pré-sintomáticos e assintomáticos (WHO, 2020 d), uma vez que não foi observada uma diferença de carga viral entre os mesmos (Zou et al 2020).
A transmissão ocorre principalmente a partir de indivíduos sintomáticos: pelo contacto próximo através de gotículas respiratórias – tosse e espirro; por contacto directo – abraço, beijo, aperto de mãos; por contacto com objectos e superfícies contaminadas. Existe a evidência laboratorial de que a concentração do vírus é elevada nas vias respiratórias altas – nariz e garganta – nos três primeiros dias após o início dos sintomas. Estes resultados sugerem que a transmissão da doença seja maior no início, diminuindo ao longo da sua evolução.
O período de incubação médio é de cinco a seis dias podendo ir até 14. O indivíduo pode ser positivo laboratorialmente um a três dias antes de desenvolver os sintomas, podendo transmitir a doença neste período. Existem alguns relatos de casos confirmados em laboratório que se mantiveram assintomáticos. Apesar de, até ao momento, não ter havido evidência de transmissão a partir desses casos, deve-se considerar a possibilidade de que possa ocorrer.
Os dados de estudos sobre a COVD-19 na China indicam que a exposição desprotegida e os contactos próximos permitiram a disseminação rápida da doença entre as pessoas. Por exemplo, mais de 85% da transmissão pessoa a pessoa ocorreu em ambiente familiar, incluindo entre os funcionários de saúde infectados fora do ambiente hospitalar (WHO, 2020 a; Wu Z and McGoogan, 2020). O mesmo padrão de transmissão foi observado fora da China, revelando que a transmissão ocorria em contactos próximos entre pessoas que frequentavam o mesmo ambiente social ou as mesmas áreas circunscritas, tais como os escritórios ou navios cruzeiros (National Institute of Infectious Diseases, 2020; Rothe et al., 2020).
Uma particularidade do coronavírus é a sua grande capacidade de mutação. Contudo, o modo de transmissão da infecção do agente mantém-se ao longo dos tempos. Olhando para os antecedentes, o surto da síndrome respiratória aguda grave (SARS) que ocorreu em finais de 2002, no Sul da China, resultou em mais de 8000 casos em 29 países, com mais de 800 mortes (taxa de mortalidade de 9,6%) e só diminuiu em meados de 2003. Esse surto tinha sido causado por um coronavírus que tinha sofrido uma mutação e por isso foi chamado CoV-1. Em quase todos os casos que ocorreram também havia um histórico de contacto próximo com um paciente de SARS ou de viagens recentes para uma área onde esta tinha sido relatada (Lee et al., 2003). Nessa altura, as viagens aéreas internacionais permitiram que a SARS se espalhasse pelo mundo a uma velocidade sem precedentes. Esse mesmo padrão verifica-se hoje na pandemia da COVID-19, causada pelo novo coronavírus (SARS-CoV-2), cujos primeiros casos surgiram em uma província Chinesa em finais de 2019 e continua a causar milhares de mortes em todos os continentes a um ritmo assustador nos dias de hoje (WHO, 2020 b; WHO, 2020 c).
Portanto, essa experiência com a SARS ilustra bem que, em um mundo globalizado, um surto de doença infecciosa em qualquer lugar põe em risco toda população do mundo, sem excepção. Daqui depreende-se a importância da identificação precoce de pessoas que tiveram contacto com os casos (suspeitos), o isolamento dos casos, o cumprimento do distanciamento físico entre as pessoas (pelo menos 1 metro) que deve ser observado mesmo entre as pessoas aparentemente sãs. Os dados de um estudo recente sobre a COVID-19 realizado em Wuhan, China, sugerem que o início tardio ou o relaxamento das medidas de distanciamento físico entre as pessoas em diferentes ambientes estavam na base do ressurgimento de casos de infecção na comunidade (Prem et al., 2020).
Importa ressaltar que, em algumas situações, os coronavírus sofrem mutações e multiplicam-se rapidamente dentro do organismo do paciente. Como consequência, esses pacientes tornam-se em “super-propagadores” da infecção, sendo capazes de transmiti-la para um elevado número de pessoas com que estes entrarem em contacto (Jawetz Melnick, & Adelberg’s, 2016, p.4).
Medidas de mitigação da infecção
A actual de mitigação da COVID-19 deve estar direccionada à comunidade, para atrasar-se a propagação exponencial dos casos, e deve incluir (Ebrahim et al 2020; Qualls et al 2020;WHO, 2020e; Pandey et al 2014; Markel et al 2014):
- O cancelamento de eventos com elevado número de aglomerado populacional: a restrição de eventos como festivais de música, encontros religiosos, desportivos, culturais, conferências e eventos políticos aumentam a probabilidade de transmissão mesmo em situações em que o R0 é baixo.
- O distanciamento social contribui para a redução da frequência e duração do contacto de pessoas em todas as idades. O encerramento de escolas e universidades, igrejas, locais de entretenimento e outros espaços é fundamental para a diminuição de aglomerados populacionais. Estudos referem que a concentração populacional em escolas é de 3-4 m2/criança comparado com o de escritórios de serviço que é de 18 m2/pessoa. Apesar disso deve-se diminuir a densidade de trabalhadores com a adopção de novos horários de trabalho e a rotação por turnos para minimizar a transmissão da doença.
- As viagens constituem um dos factores de disseminação da doença. Contribuem para a importação de casos e a disseminação no país. A restrição de viagens internacionais constitui uma das medidas que os governos devem adoptar sem prejuízo dos serviços essenciais.
- A quarentena institucional é pouco prática quando a epidemia está instalada devido a sobrecarga dos serviços e os gastos adicionais. A quarentena domiciliar voluntária é a melhor opção em situações em que a concentração populacional intra-domiciliar o permitam. Outro aspecto de extrema importância é o grau de responsabilidade dos indivíduos, para manterem-se em casa durante o período de quarentena.
- Directrizes para as alterações dos serviços funerários são de extrema importância. Em países como o nosso os funerais são conduzidos em casa, com grande concentração de familiares e amigos e muitas vezes com a manipulação dos corpos.
- Comunicação clara do aumento da propagação da doença às autoridades nacionais e internacionais de saúde são fundamentais para preservar a calma e uma resposta compatível aos conselhos de mitigação entre o público.
Para todas essas acções de mitigação, o momento em que as mesmas são adoptadas são fundamentais para o controlo da epidemia. Cada país deve calcular o risco e aplicar cada uma destas medidas atempadamente.
Associadas a estas medidas devem-se manter todos os passos de vigilância epidemiológica e as medidas individuais de protecção.
Período de infecciosidade
A doença COVID-19 é altamente contagiosa. Tendo em conta a amplitude do período de incubação (um a 14 dias), o perigo de infecção está presente desde que o indivíduo tenha o contacto com a fonte de infecção (humana ou objectos). Deste modo, a doença pode ser transmitida inclusive pelos portadores assintomáticos (directa ou indirectamente), mesmo durante o período de incubação, indicando a necessidade de se fazer uma busca activa dos contactos assim como de todos os indivíduos não suspeitos, pois existe o risco de propagação da infecção em massa.
Imunidade
Geralmente o organismo produz anticorpos (imunoglobulina G, IgG) protectores contra a presença dos coronavírus por volta da segunda semana ou muito depois. Essa protecção pode persistir por várias semanas até anos e pode proporcionar a protecção contra a reinfecção pelo mesmo vírus (Jawetz Melnick, & Adelberg’s, 2016, p.5). No caso da infecção pelo SARS-CoV-2, os dados científicos sobre o nível e duração da imunidade proporcionada por anticorpos contra o vírus da COVID-19 são escassos. O facto de que muitos pacientes se recuperarem da infecção por COVID-19 sem manifestar os sintomas da doença sugere uma possível resposta, e tudo isso exige uma regulação precisa para eliminar-se os vírus sem causar doença imunológica.
Foi observado que os pacientes afectados por COVID-19 apresentam relativa elevação de algumas citocinas e quimiocinas plasmáticas, incluindo interleucinas (IL): IL-1, IL-2, IL-4, IL-7, IL-10, IL-12, IL-13, IL-17, factor estimulador de crescimento celular (GCSF), factor estimulador de colónias de macrófagos (MCSF), IP-10, MCP-1, MIP-1α, factor de crescimento de hepatócitos (HGF), IFN-γ e TNF-α (Huang et al 2020; Chen et al 2020; Liu et al 2020). Pensa-se que em pacientes admitidos nos cuidados intensivos em estado crítico, a elevação das citocinas pró-inflamtórias seja responsável pela gravidade da doença e incluem as IL2, IL7, IL10, os GCSF, IP10, MCP1, MIP1α e o TNFα (Huang et al 2020). Contudo estão em curso estudos em vários países, para testar se os pacientes que se recuperaram da COVID-19 desenvolveram anticorpos imunizadores (Jawara, 2020).
Mecanismos fisiopatológicos da infecção
A informação existente sobre os coronavírus tem revelado que eles têm uma grande afinidade às células epiteliais do tracto respiratório onde causam alterações que levam ao surgimento de doença respiratória que pode ser severa.
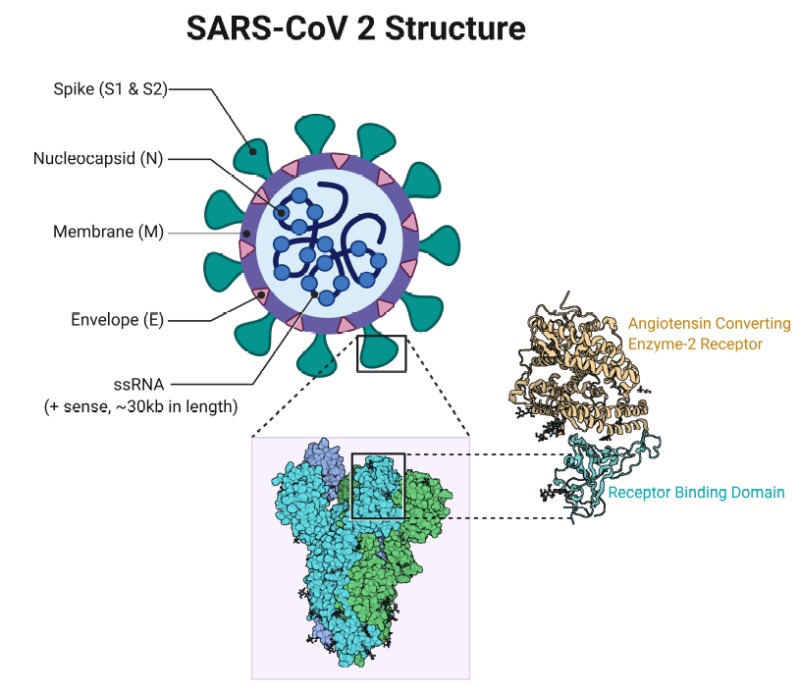
O vírus liga-se ao receptor da célula do epitélio alveolar (principalmente nos pneumócitos tipo II) através da sua glicoproteína de membrana S que se encontra no envoltório da “coroa”. Uma vez dentro da célula infectada, o vírus inicia o processo de replicação do seu RNA para sintetizar um conjunto de proteínas incluindo os factores inflamatórios que desencadeiam as alterações fisiopatológicas que levam ao surgimento das manifestações de doença respiratória (Jawetz Melnick, & Adelberg’s, 2016, p.4-5).
Foi descrita que, no caso do vírus SARS-CoV, este liga-se a enzima conversora da angiotensina 2 (ECA2) que serve como receptor celular e regula a transmissão de espécies cruzadas e de pessoa para pessoa (Jia et et al., 2020; Wan et al., 2020). O SARS-CoV-2 também usa o mesmo receptor de entrada celular descrito para o SARS-CoV (Zhou et al., 2020). Entretanto, os estudos recentes têm mostrado que o SARS-CoV-2 tem uma afinidade aos receptores ECA2 que é 10 a 20 vezes maior do que a do SARS-CoV o que o torna muito mais virulento (Hoffmann et al., 2020; Wrapp et al., 2020). Como consequência, pode não ser necessária uma grande quantidade de vírus para causar uma infecção nos pacientes.Deste modo, a glicoproteína S que se encontra na superfície do coronavírus liga-se ao receptor ECA2 que se encontra na superfície das células humanas (Guo et al., 2020). A ECA2 é encontrada na maioria dos tecidos e amplamente distribuída no coração, rins, pulmões e testículos (Donoghue et al., 2000; Ohtsuki et al., 2010). Contudo, os mecanismos moleculares mais detalhados de ligação viral e modos de entrada continuam ainda em estudo (Guo et al., 2020).
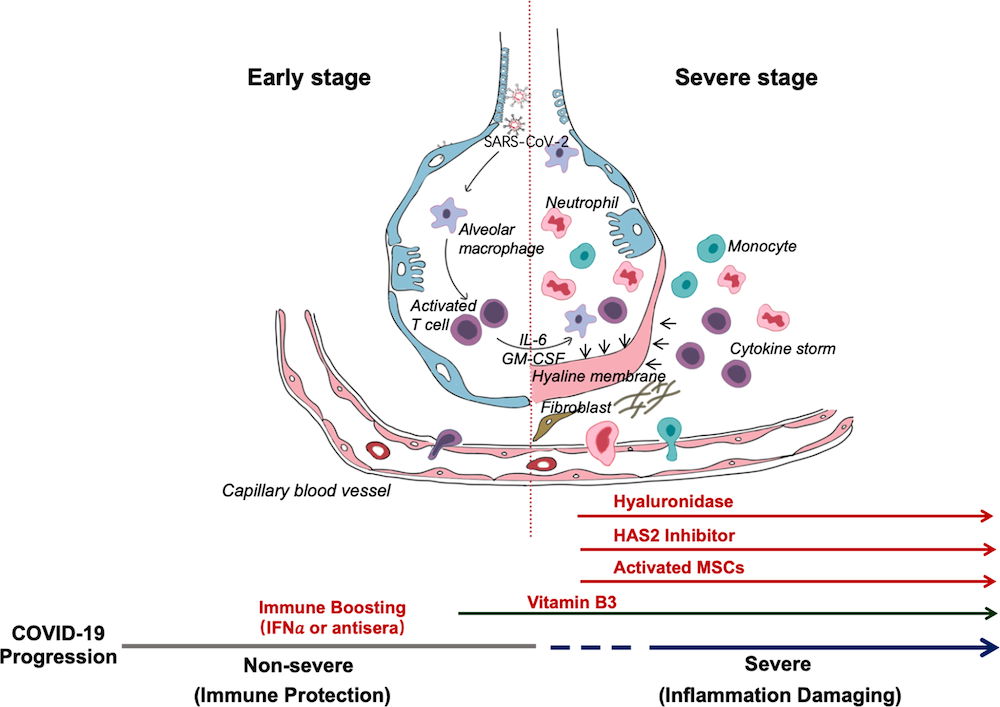
Representação esquemática da progressão da COVID-193
Após a fusão da membrana, o RNA do genoma viral é liberado no citoplasma e o RNA não revestido traduz duas poliproteínas, pp1a e pp1ab, que codificam proteínas não estruturais e formam o complexo de replicação e transcrição (Sawicki & Sawicki, 2005; Wilde et al., 2018;). Essas poliproteinas específicas são utilizadas também para a síntese do nuleopcapside do vírus, proteinas da glicoproteina S e enzimas específicas, em presença de proteases específicas sintetizadas nos ribossomos das células do epitélio alveolar. O vírus pode causar a lise dos pneumócitos e estes libertam várias substâncias incluindo os factores activadores dos macrófagos.
Os macrófagos activados acabam por produzir as citocinas e quimiocinas pro-inflamatórias, principalmente as IL1, IL6 e o TNF-α que, dentre outros efeitos, aumentam a permeabilidade capilar e causam a vasodilatação que pode levar ao surgimento de edema pulmonar em casos graves. A combinação da lise dos pneumócitos II (produtores de surfactante) associada ao edema interstcial e alveolar, juntos, leva à hipoxémia e consequente manifestação sob a forma de tosse e dispneia grave. A disseminação de citocinas na corrente sanguínea atinge vários órgãos incluindo o centro termorregulador no hipotálamo em que as IL1, IL6 e o TNF-α levam ao surgimento da febre mediada por prostaglandinas (E2). Uma vez instalada, a hipoxémia pode levar a estimulação dos quimiorreceptores que activam o sistema nervoso simpático causando o aumento reflexo da frequência cardíaca.
Por outro lado, tem sido sugerido que infecção por SARS-CoV-2 pode diminuir a ECA2, levando a uma superacumulação tóxica da angiotensina II que induz a síndrome do desconforto respiratório agudo e miocardite fulminante (Hanff et al., 2020). Por outro lado, a presença do vírus da COVID-19 está associada a uma elevada resposta inflamatória que pode induzir a inflamação vascular, miocardite e arritmias cardíacas. A carga inflamatória provavelmente induz a resposta imune localizada e sistêmica (Madjid et al., 2020). Alguns casos apresentam altos níveis de citocinas pró-inflamatórias que promovem a gravidade da doença (Huang et al., 2020). Duma maneira global, a presença níveis sistémicos de citocinas pró-inflamtórias em ambiente de hipoxemia pode levar a um quadro de septicemia.
No entanto, a angiotensina II também pode promover a ocorrência de edema pulmonar e comprometimento da função pulmonar. A síndrome do desconforto respiratório agudo é a forma mais grave de lesão pulmonar e, se caracteriza principalmente pelo aumento da permeabilidade vascular provavelmente induzida por sépsis (Imai et al., 2005). Na sua maioria os pacientes desenvolvem a pneumonia, mas alguns podem evoluir com uma disfunção de outros órgãos, levando ao choque, disfunção múltipla de órgãos e eventualmente a morte.
1- https://www.fpm.org.uk/blog/covid-19-sars-cov-2-pandemic/
2- https://www.thelancet.com/pdfs/journals/lancet/PIIS0140-6736(20)30567-5.pdf
3- https://www.nature.com/articles/s41418-020-0530-3
Referências bibliográficas
Backer JA, Klinkenberg D, Wallinga J. Incubation period of 2019 novel coronavirus (2019-nCoV) infections among travellers from Wuhan, China, 20-28 January 2020. Euro Surveill. 2020; 25.
Bassetti M, Vena A, Giacobbe DR.The novel Chinese coronavirus (2019-nCoV) infections: Challenges for fighting the storm.Eur J Clin Invest. 2020; 50:e13209. doi. org/10.1111/ec.
Chen C, Zhang XR, Ju ZY, He WF. Advances in the research of cytokine storm mechanism induced by Corona Virus Disease 2019 and the corresponding immunotherapies. Zhonghua Shaoshang Zazhi. 2020;36(0): E005.
Donoghue M, Hsieh F, Baronas E, et al. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9. Circulation research 2000; 87: E1-E9.
Ebrahim SH, Ahmed QA, Gozzer E, et al. Covid-19 and community mitigation strategies in a pandemic. BMJ 2020; 368:m1066 doi: 10.1136/bmj.m1066.
Guo Y, Cao Q, Hong Z, Tan Y, Chen S, Jin H, Tan K, Wang D, Yan Y. The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak – an update on the status. BMC. 2020; 7:11. doi.org/10.1186/s40779-020-00240-0.
Hanff TC, Harhay MO, Brown TS, Cohen JB, Mohareb AM. Is There an Association Between COVID-19 Mortality and the Renin-Angiotensin System—a Call for Epidemiologic Investigations. Clinical Infectious Diseases, 26 March 2020. doi.org/10.1093/cid/ciaa329.
Hoffmann M, Kleine-Weber H, Schroeder S., et al. SARS-CoV-2 Cell entry depends on ACE2 and TMPRSS2 and is Blocked by a clinically proven protease inhibitor, Cell 2020 (181): 271–280.
Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, Zhang L, Fan G, Xu J, Gu X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China, Lancet 395 (10223) (2020) 497–506, https://doi.org/10.1016/S0140-6736(20)30183-5.
Imai Y, Kuba K, Rao S, et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature 2005; 436: 112-116. DOI: 10.1038/nature03712.
Jawetz Melnick & Adelberg’s Medical Microbiology, 27th ed. McGraw-Hill Education, 2016; p. 602-605.
Jawhara S. Could Intravenous Immunoglobulin Collected from recovered coronavirus patients protect against COVID-19 and Strengthen the Immune System of New Patients? Int J Mol Sci 21: 2020.
Jia HP, Look DC, Shi L, Hickey M, Pewe L, Netland J, et al. ACE2 receptor expression and severe acute respiratory syndrome coronavirus infection depend on differentiation of human airway epithelia. J Virol. 2005;79(23): 14614–21.
Li Q, Guan X, Wu P, Wang X, Zhou L, Tong Y, et al. Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia. N Engl J Med [Preprint]. 2020 [cited 2020 Feb 16]: [9 p.]. https://doi.org/10.1056/NEJMoa2001316.
Liu Y, Zhang C, Huang F, Yang Y, Wang F, Yuan J, et al. 2019-novel coronavirus (2019-nCoV) infections trigger an exaggerated cytokine response aggravating lung injury. 2020. http://www.chinaxiv.org/abs/202002.00018.
Lu H, Stratton CW, Tang Y. Outbreak of pneumonia of unknown etiology in Wuhan, China: The mystery and the miracle. J Med Virol. 2020; 92:401–402. DOI: 10.1002/jmv.25678.
Madjid M, Safavi-Naeini P, Solomon SD et al. Potential Effects of Coronaviruses on the Cardiovascular System. JAMA Cardiol. March 27, 2020. doi:10.1001/jamacardio.2020.1286.
Markel H, Lipman HB, Navarro JA, et al . Non pharmaceutical interventions implemented by US cities during the 1918-1919 influenza pandemic. JAMA 2007;298:644-54.10.1001/jama.298.6.644 17684187.
Ohtsuki M, Morimoto S-I, Izawa H, et al. Angiotensin converting enzyme 2 gene expression increased compensatory for left ventricular remodeling in patients with end-stage heart failure. International journal of cardiology 2010; 145: 333-334. DOI: 10.1016/j.ijcard.2009.11.057.
Pandey A, Atkins KE, Medlock J, et al . Strategies for containing Ebola in west Africa. Science 2014;346:991-5. 10.1126/science.1260612 25414312.
Prem K, Liu Y, Russell TW, et al. The effect of control strategies to reduce social mixing on outcomes of the COVID-19 epidemic in Wuhan, China: a modelling study. Lancet Public Health 2020; published online March 25. https://doi.org/10.1016/ S2468-2667(20)30073-6.
Prompetchara E, Ketloy C, Palaga T. Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic. Asian Pac J Allergy Immunol 2020; 38:1-9. DOI 10.12932/AP-200220-0772.
Qualls N, Levitt A, Kanade N, et al. CDC Community Mitigation Guidelines Work Group. Community mitigation guidelines to prevent pandemic influenza-United States, 2017. MMWR Recomm Rep 2017;66:1-34. 10.15585/mmwr.rr6601a1 28426646.
Rothe C, Schunk M, Sothmann P, et al. Transmission of 2019-nCoV infection from an asymptomatic contact in Germany. N Engl J Med 2020; 382: 970–71.
Sawicki SG, Sawicki DL. Coronavirus transcription: a perspective. Curr Top Microbiol Immunol. 2005; 287: 31–55.
The National Institute of Infectious Diseases, Japan. Field briefing: Diamond Princess COVID-19 cases. Feb 19, 2020. https://www.niid.go.jp/niid/en/2019-ncov-e/9407-covid-dp-fe-01.html (accessed March 16, 2020).
Wan Y, Shang J, Graham R, Baric RS, Li F. Receptor recognition by novel coronavirus from Wuhan: an analysis based on decade-long structural studies of SARS. J Virol. 2020. doi.org/10.1128/JVI.00127-20.
Wilde AH, Snijder EJ, Kikkert M, van Hemert MJ. Host factors in coronavirus replication. Curr Top Microbiol Immunol. 2018; 419: 1–42.
WHO (2020 a). Modes of transmission of virus causing COVID-19: implications for IPC precaution recommendations. Geneva: World Health Organization; 2020. https://www.who.int/news-room/commentaries/detail/modes-of-transmission-of-virus-causing-covid-19-implications-for-ipc-precaution-recommendations
WHO (2020 b). Coronavirus disease 2019 (COVID-19). Situation report 01, 20 January, 2020. https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200121-sitrep-1-2019-ncov.pdf?sfvrsn=20a99c10_4
WHO (2020 c). Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19). February, 2020. https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf.
WHO (2020 d). Coronavirus disease 2019 (COVID-19). Situation report 73, 2 April, 2020. https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200402-sitrep-73-covid-19.pdf?sfvrsn=5ae25bc7_2
WHO (2020 e). Coronavirus disease 2019 (COVID-19). Situation report 15, 04 February, 2020. https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200204-sitrep-15-ncov.pdf?sfvrsn=88fe8ad6_4
WHO (2020 f). Coronavirus disease 2019 (COVID-19). Situation report 05, 25 January, 2020. https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200125-sitrep-5-2019-ncov.pdf?sfvrsn=429b143d_8
WHO (2020 g). Coronavirus disease 2019 (COVID-19). Situation report 51, 11 March, 2020. https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200311-sitrep-51-covid-19.pdf?sfvrsn=1ba62e57_10
WHO (2020 h). Coronavirus disease 2019 (COVID-19). Situation report 88, 18 April, 2020.https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200417-sitrep-88-covid-191b6cccd94f8b4f219377bff55719a6ed.pdf
Wrapp D, Wang N, Corbett KS, et al. Corornavirus Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 2020 (367): 1260–1263
Wu Z, McGoogan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of areport of 72 314 cases from the Chinese Center for Disease Control and Prevention. JAMA 2020; published online Feb 24. DOI:10.1001/jama.2020.2648.
Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020. doi.org/10.1038/s41586-020-2012-7.
Zou L, Ruan F, Huang M, et al. SARS-CoV-2 viral load in upper respiratory specimens of infected patients. N Engl J Med. 2020.https://doi.org/10.1056/NEJMc2001737.